今天,身处舆论漩涡中的贺建奎,如期参与了第二届国际人类基因组编辑峰会,做了关于“基因编辑婴儿”实验的演讲,并接受了现场提问。
果壳整理了贺建奎的PPT和演讲、演讲后观众提问,以及一部分参会的著名科学家的评价,形成了这篇长文。希望这篇文章能为你了解这件事以及基因编辑领域,提供更多、更客观的信息。
文章第一部分为贺建奎演讲,着重于技术细节。第二部分为Q&A,大家提出了很多共同关注的话题,比如:
究竟有多少个胚胎被制造出来了
受试者是否完全知情同意了
孩子的长期随访怎么办。
贺建奎甚至透露,除了已经降生的双胞胎露露和娜娜之外,还有一位参与者很可能已经怀孕了。
本场会议主持人,罗宾·洛弗尔-巴奇,著名的干细胞生物学和生物遗传学家,在会后评价说:“我觉得也不是业界的突破,而是一小步倒退。”
明天,峰会组委会将发布一份公开声明,请跟果壳一起持续关注。

我在此提醒大家,我们希望让贺博士有机会解释他在科学方面所做的工作,以及他在其他方面所做的事情。请大家允许他不受干扰地发言。如果演讲过程中噪音和中断太多,我有权取消会议。
我想先讲一些题外话。在他接受我们的交谈邀约时,我们并不知道在最近几天将要爆出那样的事。我们事先并不知道这件事。实际上,他已经向我发送了他将在本次会议中使用的幻灯片,但其中没有包括任何他现在将要讨论的那件事。我拿到的幻灯片中只有一些临床前数据,但没有涉及植入人类胚胎。
我还应该说我们承蒙香港大学主办此会,他们有允许言论自由的强大传统,我们遵守这一言论自由的传统。我想请贺建奎博士来到台上并展示他的工作。
我不知道他在哪里,我有点混乱。请不要讲太久。

首先我很抱歉,这一研究结果在我没在学术场合公布完整数据的情况下被意外泄露了,并且没有在本次会议之前进行同行评审。
这项研究已提交给一个期刊进行评议。我想感谢从双胞胎出生几个月前就已经与我们有联系的美联社,致力于从许多角度准确报告这项研究的结果。我也感谢我的大学,尽管他们对于这项研究的进行并不知情。感谢诸位与我分享这次演讲,以及感谢学界能够讨论这些数据并提供此论坛。
我将概述我们的实验数据,重点集中在人类和猴子。
艾滋病防治取得了很大进展,但新感染率仍然比联合国艾滋病规划署2020年目标高出3倍。在很多国家,特别是发展中国家,HIV仍然位列死亡原因前10。在非洲南部某些地区,由携带HIV病毒的母亲生出的未受感染的儿童占了很大比例,这些孩子在生命最初几个月感染HIV的风险比其他婴儿高出许多倍。
这是一个严肃的未解决的问题。歧视通常让传染情况更加严峻。
贺建奎展示了使用CRISPR/Cas9进行胚胎的CCR5靶向基因编辑策略。
其中涉及到的内容大致包括:
1,弄清楚CCR5和HIV
2,探讨CCR5基因对小鼠的发育影响
3,设计最佳人类sgRNA
4,在NHPs中开发精准的注射方案
5,将方案转化为人类胚胎+建立hESC以评估胚胎健康
6,调查NHP和人类胚胎的脱靶活动

在一些欧洲国家,高达10%的人口携带一种对天然抵抗HIV病毒的基因变异,它可以预防HIV感染。几十年来的临床试验让这个CCR5基因上的小缺失,成为被研究最多的变异之一,也是被研究得最清楚的基因之一。
我们首先在小鼠中探索CCR5基因敲除后的影响,以研究多代效应。如同预期,基因编辑的效率挺高的。我们建立了第三代CCR5敲除小鼠,我们通免疫印迹和流式细胞术证实了这一点。
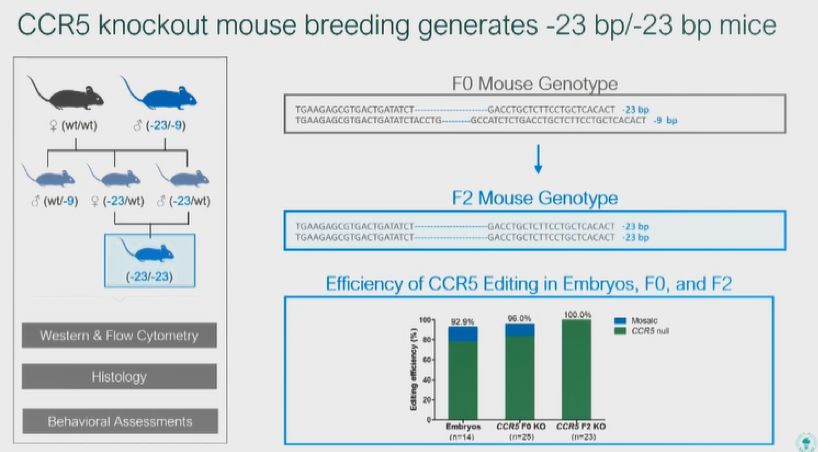
组织病理学特征在心脏、肝脏、肺和胃中表现正常。在两项常见行为评估没有显示出差异。
然后我们开始评估引导RNA是否可以用于人类CCR5的设计。我们评估了7个,找到了一个有希望的引导RNA,可以定位到△32变异的开始位置。MIT特异指数(MIT specificity score)预示其不会脱靶。一些先前的发表成果在不成活胚胎等细胞系上评估了类似的引导RNA且没有检测到脱靶。
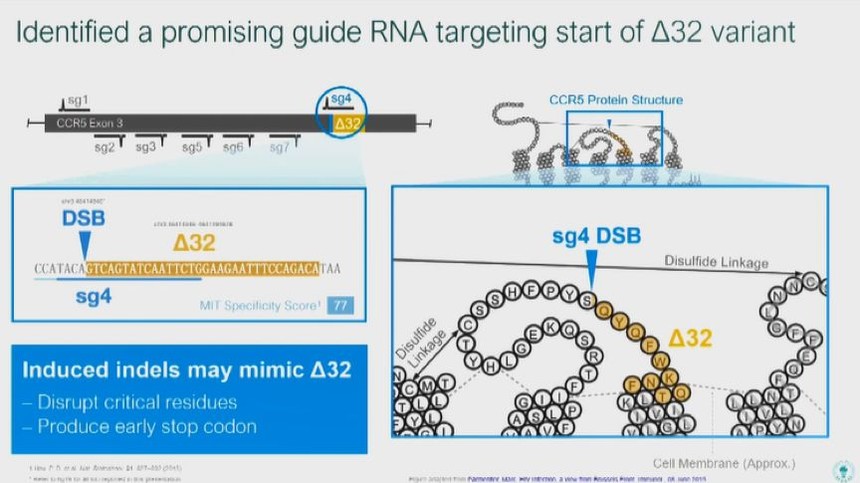
其中黄色高亮出来的,是识别出的一个有希望的引导RNA可以定位到△32变异的开始位置
这个引导RNA,sg4,在人类细胞系中诱发了最有效的编辑活动。由于这个目标位点在猴子基因组中保留,我们使用了食蟹猴(M. fascicularis)进行进一步评估。

使用的猴子是食蟹猴(M. fascicularis)
我们发现在更接近受精过程时注入Cas9可以提高编辑成功率,因为Cas9找到目标需要时间。通过实验观察,胚细胞率不受Cas9注入时间的影响。测序结果确认更早注入Cas9也减少了镶嵌现象。
为了更仔细地研究镶嵌现象,我们还对几个胚胎中的每个细胞进行了测序。编辑在1、2和3细胞阶段发生。
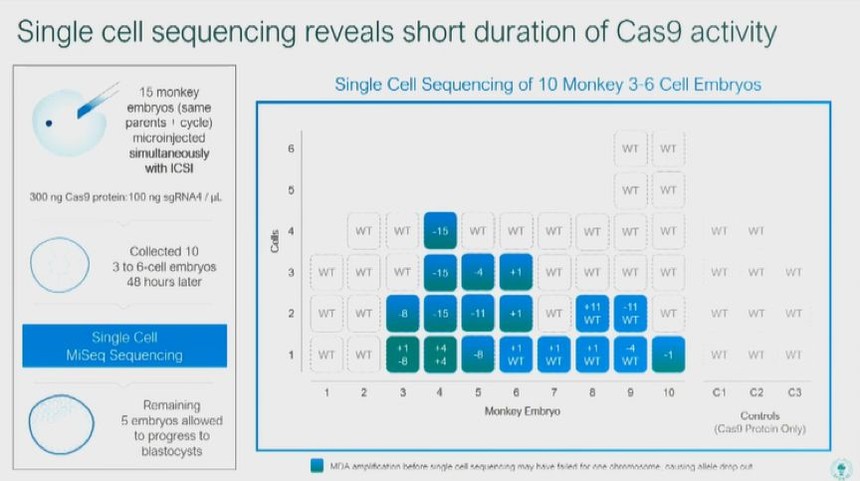
在Cas9能够迅速降解并需要时间来找到正确的目标的假设下,我们经过探索,发现通过在2细胞阶段进行第二次Cas9注射可以减少镶嵌现象。
我们扩大了样本的大小,并在亲细胞和各周期中观察到了变异存在。
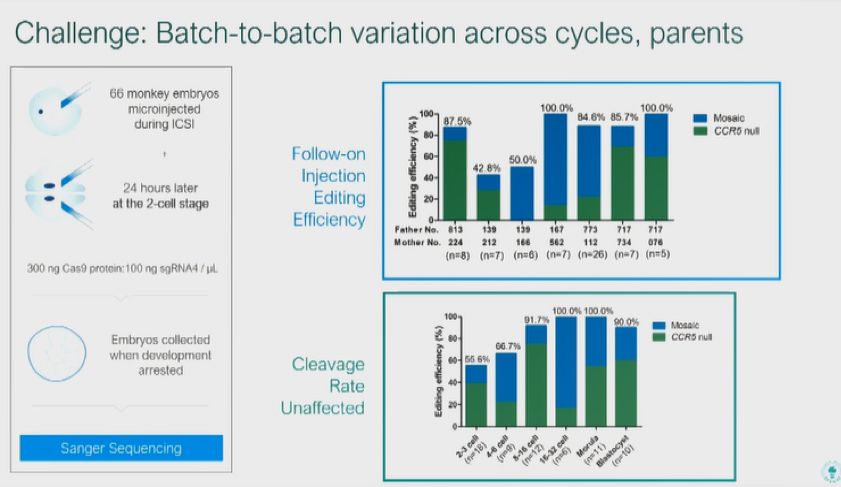
然后,我们查看该做法是否可以转化在人类胚胎上。正如其他报道所说,Cas9是最有效的递送方式。
我们发现,在猴子的实验中,降低剂量也提高了疗效。根据2017年2月早些时候我在加州大学伯克利分校基因组编辑工作室得到的建议,我们编辑了不能存活的胚胎并建立了两个胚胎干细胞系。通过染色和流式细胞术,胚胎干细胞标记物表达也是正常的。在14天的实验中,这种胚胎干细胞也形成了所有三种种系,这是安全性的标志。
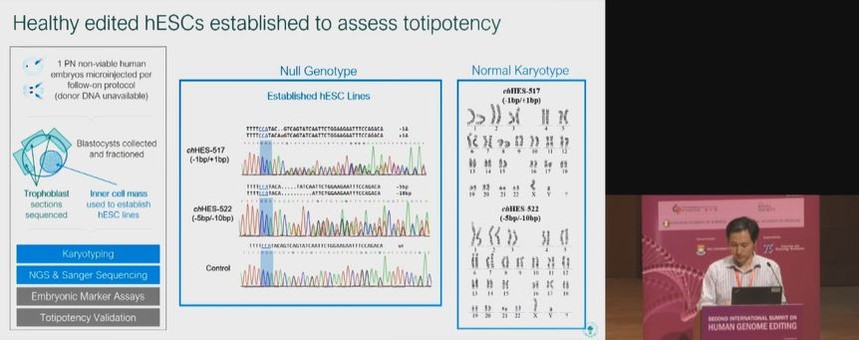
另一个严重的安全问题是脱靶效应。胚胎编辑针对生命的单个或几个细胞阶段,任何脱靶都会造成非常严重的后果并可能通过整个身体蔓延。在成人基因治疗中,有脱靶的可能性,但其带来的健康问题相对更少。
我们在植入前通过胚胎的单细胞全基因组测序评估脱靶。我们使用扩增方法来最小化假阳性率,以实现无偏覆盖率。其他实验室也使用了相同的方法。但我们更进一步,通过对亲本基因组进行测序以检测特定胚胎中和亲本细胞中存在的脱靶风险位点,而不是参考其他基因测序的结果。
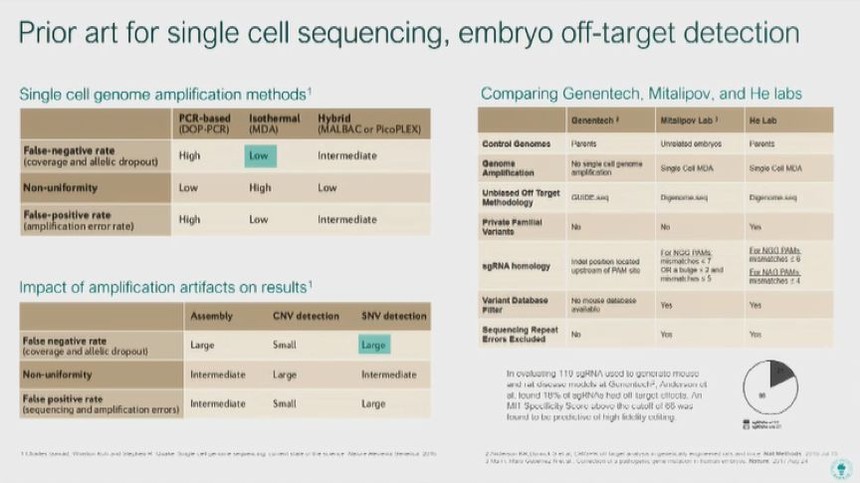
我们通过首先收集以前发表文章中提到的内容创建了一组脱靶目标。 我们添加了基因组位点,用于对可能的交付位点的无偏见评估。我们对CRISPR设计进行了计算机预测,用于错配引导的计算设计。
最后,我们导入亲本基因组,这提高了灵敏度,并允许我们检测每个胚胎特有的新风险位点。这些位点来自遗传的SNPs。
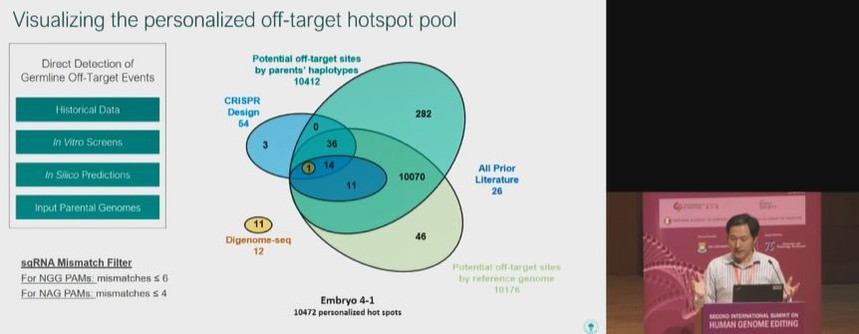
我们能够可视化个人化的脱靶热点池,每个胚胎10000个站点。我们使用全基因组测序来评估这些点,并通过单细胞测序验证一切发现。
我将在最后回顾有关露露和娜娜的测序数据。
在通过全基因组无偏方法鉴定的潜在切割位点中,没有任何一个在全基因组测序数据中被观察到。MIT CRISPR 设计的原始版本和2018更新版中的风险点位,在50个人类胚胎中均未发现任何活动。
我们研究了hESC细胞系中的脱靶,hESC细胞系源于编辑后的胚胎。我们虽然没有用父母提供的基因组评估胚胎,但是我们能确定存在一个潜在的脱靶。脱靶的部位是某个基因间区,但是我们无法确定脱靶是由遗传造成的,还是编辑基因造成的。
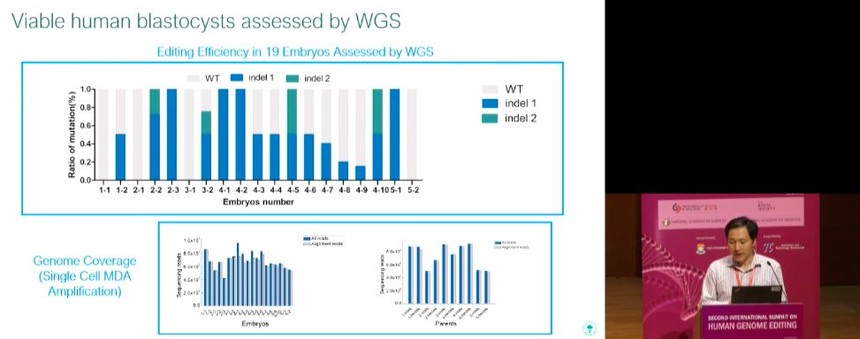
上图,可以看到一对志愿者提供的19个可用胚胎的功效。我们在整个胚胎中进行了植入前遗传学诊断和全基因组测序,并没有识别到脱靶位点。
我们在一个胚胎的靶标位点上鉴定出6 kb缺失,这个缺失只影响CCR5基因,并不影响其他的基因。CCR5基因与其他基因的有一段间隔,可以降低大量其他基因缺失的风险。
我们通过评估嵌合读数和视觉确认来检测其他基因是否有大量的缺失。
为了脱靶检测,我们对双亲的基因组进行测序。母亲呈HIV阴性。父亲呈HIV阳性,但未测出病毒载量。为了防止感染HIV病毒,我们清洗了精子。第5天,我们从囊胚中取得了几组样本,以进行植入前遗传学诊断。
母亲怀孕期间拒绝羊膜穿刺术,我们通过取样DNA跟踪上述结果。最后,露露和娜娜正常降生了,并且很健康。

妊娠19和24周所取得胎儿游离DNA中未能检测到前述的潜在脱靶现象
两位婴儿降生后,我们测序了几种不同的组织。通过植入前遗传学诊断,我们发现两个被编辑过的囊胚中,一个出现了移码锁定,它能缩短CCR5蛋白,类似于天然保护性变异。另一个囊胚中的CCR5有一处框内删除。当CCR5被删除之后,有望破坏HIV结合位点附近的局部蛋白质结构。
我们告诉这对父母这意味着什么,也告诉他们可以中断植入试验或选择野生型胚胎。这对夫妇选择植入胚胎,母亲开始孕育双胚胎。
除了单一数据,我们将全基因组测序数据告诉给了志愿者。数据的读数覆盖了80%以上的基因组。全基因组测序发现了一个脱靶效应,脱靶效应发生在meg的基因间区中,meg基因区间离其他的基因较远,而且此基因区间没有编码RNA和转录因子的结合位点。
我们告知志愿者可能有一个潜在的脱靶效应,但是他们仍旧决定植入胚胎。
母亲拒绝进行羊膜穿刺术,但是对囊胚进行连续cfDNA测序后,没有观察到植入前遗传学诊断中检测出来的基因间脱靶。另一个cfDNA测试也没有发现肿瘤基因突变。
婴儿出生后,我们用主要是婴儿血的脐带血进行深度测序。深度测序证实了在植入前遗传学诊断和cfDNA测序中观察到的基因编辑模式。桑格测序也证实了这一观察结果。
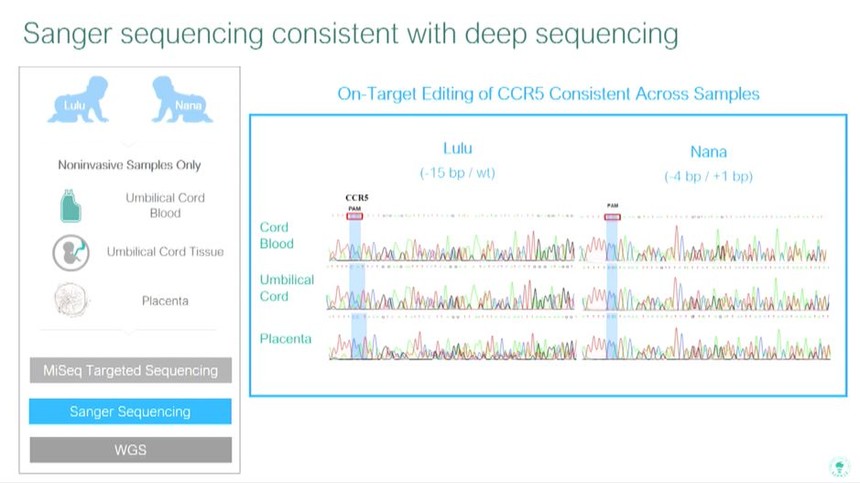
桑格测序结果与深度测序一致。左侧:内容同上一张,桑格测序标蓝;右侧:目标CCR5的编辑在样品之间一致
出生后,MiSeq深度测序和Sanger测序均未检测到植入前遗传学诊断期间观察到的基因间脱靶。这表明这是单细胞扩增的假象,或者是发生在为植入前遗传学诊断取样的少数囊胚细胞中的镶嵌脱靶。
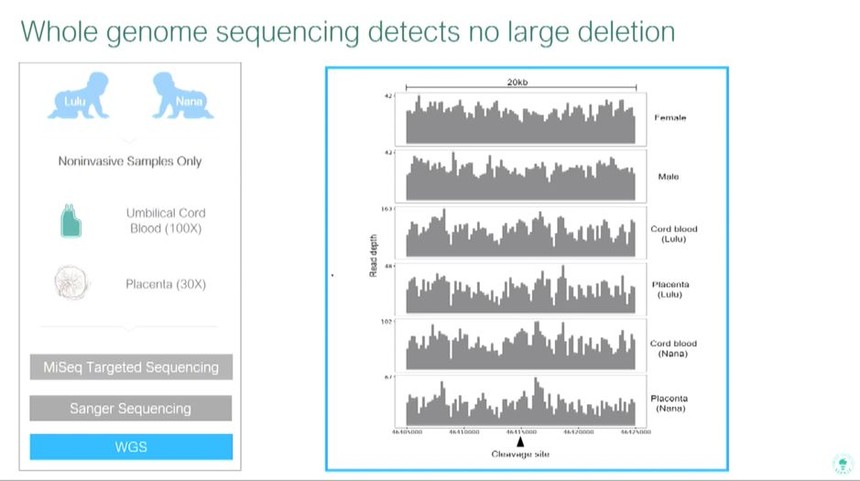
为了对全基因组进行测序,我们做了100X脐带血,在胎盘上做了30X。在被测的基因组范围内,没有观察到脱靶效应,也没有看到明显的基因缺失。
我们将继续评估基因链中的编辑效果,我们会通过受试者的血液样本测试HIV易感性,我们实验的生物安全水平将达到3级。我们还会进一步研究多个组织中的镶嵌脱靶效应。
我们计划在未来18年内对两个孩子进行监测,希望他们在成年后同意继续接受监测和帮助。
资深科普作者、长期从事基于基因编辑技术的动物模型制作与基因治疗等科研工作的鬼谷藏龙,对这段技术部分做了如下点评:
从PPT披露的信息来看,果然还是没有出现我很期待的“嵌合率”数据。一个比较违反直觉的事实是,直接在受精卵当中注射CRISPR/Cas9系统产生的后代在基因型上是“嵌合”的。因为基因编辑工具并不是一进入细胞马上就开始工作的,它需要一段时间来做“准备工作”,真正完成编辑的时候胚胎可能已经进入四细胞期甚至更晚了。因此这些孩子身上并不是每个细胞都能得到编辑,得到编辑的细胞也可能存在多种编辑结果。
理论上讲,要知道嵌合率,就得把胚胎或个体中相当多的细胞都拿出来做基因测序,不过这很可能会杀死胚胎或个体。在这个研究当中比较合理的做法是,将其它那些做过基因编辑但没有移植的胚胎拿来做检测,以此估计那两个移植了的胚胎的嵌合率大概是个什么水平。
由于没有嵌合率的数据,贺着重强调的编辑准确率和脱靶率数据也就显得很苍白了。无论是少掉15个碱基也好,少掉3个碱基也好,都只能代表他取出来检测的那几个细胞或是那一些组织样本中占优势的基因型,我们无法知道这样的基因型在整个胚胎当中占有多大比例。此外,他所说的双敲和单敲其实也是在假定取样的细胞的基因型都一致的基础上得出的结论,也并非十分可信。
脱靶率自然也有这样的问题。但在我看来,脱靶率的检测还有更大的问题。检测脱靶用到了一种叫做“深度测序”的技术,这种技术要求提供相当大量的DNA样本,可是在对人体不造成永久性伤害的前提下,获取的DNA的量通常是远远不够的,因此贺在测序之前经过了一步叫做“扩增”的步骤,简单来说就是把DNA复制许多份。但是他所用的扩增技术是会出错的,这些DNA的副本和原本并非完全一致,扩增得越多,错得就越多,因为错误的副本也会作为模板参与到扩增当中,在他的检测当中,DNA扩增的倍数少说也要上万亿,这会带来巨量的出错,导致产生很大的“测序噪音”,这些噪音很可能会掩盖脱靶的信号。
另外,他的脱靶检测只针对于软件预测的“潜在脱靶位点”,但是从最近的一些研究来看,脱靶发生的位置未必就一定在“潜在脱靶位点”上,但贺很明显忽视了这一点。
免责声明:本文为网络摘录或转载,版权归原作者所有,内容为原作者个人观点,并不代表本站赞同其观点和对其真实性负责。如涉及作品版权问题,请与我们联系,我们将在第一时间删除内容!
来源:果壳

















